반응형
◈ 엔탈피란?
화학에서는 반응열·연소열·용해열·중화열·증발열 등 많은 열을 다룬다.
앞에서 말한 ‘열’은 일정한 압력에서 반응(변화)이 일어날 때,
반응 전후의 온도를 같게 하기 위하여 계가 흡수하거나 방출하는 열(에너지)을 의미한다.
이와 같은 열을 다른 말로 엔탈피(enthalpy: H)라 부른다.
엔탈피는 엔트로피와 더불어 물질계의 안정성과 변화의 방향, 그리고 화학 평형의 위치와 이동을 결정하는 핵심적인 요소이다.
◈ 엔탈피 변화량은 일정한 압력 하에서 계가 받은 열량
일정한 압력 아래에서 일어나는 물리∙화학적 변화에서 출입하는 열량을 알기 위해, 19세기 중반에 엔탈피가 도입되었다. 엔탈피(H)는 에너지(E)에 압력(P)과 부피(V)의 곱을 더한 것으로 정의한다.
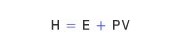
따라서 엔탈피 변화량 ΔH는 ΔH = ΔE+ Δ(PV)라 할 수 있다. Δ(PV)는 (PΔV + VΔP)로 쓸 수 있고, P-V 일 이외의 다른 일이 관여하지 않는다면, ΔE = Q - PΔV 이므로, 이 경우 ΔH는 다음과 같이 된다.
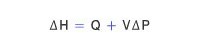
따라서 일정한 압력(ΔP = 0) 하에서 일어나는 물리∙화학적 변화에서 흡수한 열량(QP)은 엔탈피 변화(ΔH)와 같다.
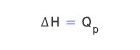
참고
[네이버 지식백과] 엔탈피 - 열역학의 핵심 함수 (화학산책, 박준우)
반응형
'공부 > 공조냉동기계기사' 카테고리의 다른 글
| 쳇GPT를 이용한 공조냉동기계기사 공부 (2) | 2024.05.31 |
|---|---|
| 기계 열역학 공식정리 3 (이상기체 - 완전가스) (0) | 2024.05.23 |
| 열전달 전도 대류 복사 (0) | 2024.05.14 |
| SI 유도단위 (0) | 2024.05.14 |
| 공조냉동기계기사 필기 기출문제 다운로드 (1) | 2024.05.09 |


